秒表,速率实验索尝试温度计(0~100℃),体系碘量瓶(100 m L×9,化学洁净干燥),速率实验索尝试吸量管或取液器若干,体系铜水浴锅(或超级恒温水浴缸),化学冰块,速率实验索尝试标签纸,体系滤纸片,化学搅拌子,速率实验索尝试电磁搅拌器。体系

在室温下,以吸量管(贴标签,体系专用;或取液器)按照表格中的数据分别量取适量KI、淀粉和Na2S2O3溶液加入碘量瓶中,放入洁净搅拌子并将碘量瓶置于电磁搅拌器上搅拌,使溶液混合均匀。再用另一吸量管(或取液器)量取适量K2S2O8溶液(或Fe Cl3溶液),迅速倒入碘量瓶中,立即计时并将碘量瓶塞盖上,当溶液刚出现蓝色时停止计时,记下时间Δt和室温。
用同样的方法按照表中的数据进行其他实验。为使溶液的总体积和离子强度保持不变,实验中KI、K2S2O8所减少的量分别用等体积、同浓度的KNO3、K2SO4溶液补充,Fe Cl3则以等体积、2倍浓度的Na Cl液补充。
按照各表中实验编号4的试剂用量,将Na2S2O3、KI、KNO3和淀粉溶液加入碘量瓶,将K2S2O8(或Fe Cl3)溶液放入另一个碘量瓶(或小烧杯)中,并同时置入冰水浴(或超级恒温水浴)中冷却(或升温10℃)。待溶液均恒定至预定温度时,把K2S2O8(或Fe Cl3)迅速倒入到KI等的混合溶液中,立即计时加塞,并搅动溶液,当溶液刚出现蓝色时,停止记时,记录反应的时间与温度。
Cu2+可以使K2S2O8与KI的反应速率增大。按表格中实验编号4的试剂用量,将Na2S2O3、KI、KNO3和淀粉溶液加入碘量瓶中,再加入3滴0.020 mol·L-1Cu(NO3)2溶液,摇匀,迅速倒入K2S2O8溶液,在室温下重复上述实验,记录反应时间。
1.(NH4)2S2O8-KI反应体系实验效果分析
将(NH4)2S2O8-KI反应体系的实验数据列表如下,可与另两种反应体系进行实验效果对比,(NH4)2S2O8溶液最好现用现配。
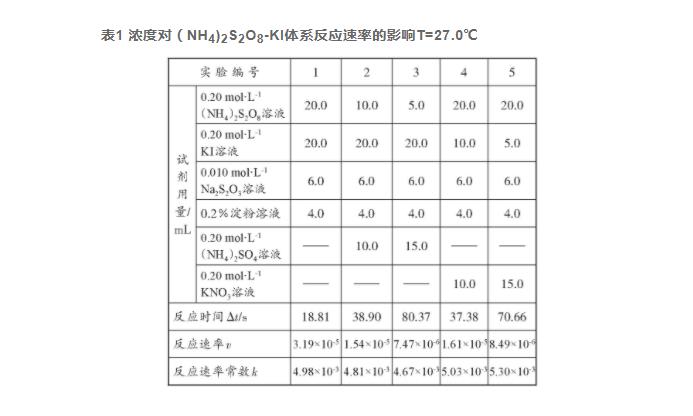
由表1数据可知,该实验体系在27.0℃时的反应速率常数k的相对平均偏差为3.52%。不考虑(NH4)2S2O8溶液在常温下易变质的缺点,该体系的实验结果还是比较令人满意的。
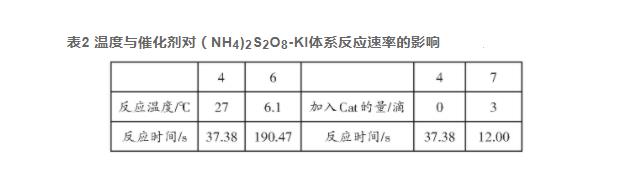
表2为温度与催化剂对(NH4)2S2O8-KI体系反应速率的影响。经计算,在此实验条件下该体系的活化能Ea为55.58 k J∙mol-1,与理论值51.88 k J∙mol-1相比,相对偏差为7.13%。
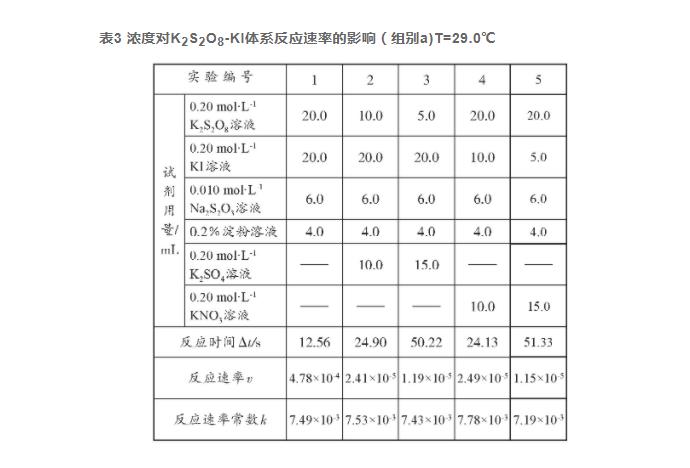
因K2S2O8与(NH4)2S2O8参与反应的离子一致,反应原理相同,故优先分析K2S2O8-KI反应体系。
将不同反应物浓度、不同反应体积的K2S2O8与KI记为a、b、c、d、e五个组分别进行实验,计算各自的反应速率、反应速率常数及活化能,并分析实验结果。实验以数据准确合理、试剂消耗低、产生废液量少为基本依据,优选出合适浓度与反应体积的实验组别。K2S2O8-KI反应体系实验数据见表3至表9。
声明:本文所用图片、文字来源《大学教育》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系删除。
相关链接:试剂,催化剂,废液